2 De Vossenlintworm:
Echinococcus multilocularis
De vossenlintworm en de infectie door deze parasiet bij de mens vormen de laatste decennia het onderwerp van tal van wetenschappelijke artikels. Een zoekopdracht in Web of Science met als zoekterm “Echinococcus multilocularis” levert al gauw een paar duizend artikels op. Zowat alle tekstboeken over humane parasitologie besteden actueel, in tegenstelling tot enkele decennia geleden, uitgebreid aandacht aan deze zoönose. Hoewel men uit deze veelheid aan informatie zou kunnen afleiden dat alle details nu wel uitvoerig beschreven zijn, blijven er nog steeds belangrijke kennishiaten, bv. symptomen van en mortaliteit door EM-infectie bij tussengastheren (Romig et al. 2017). Verschillende facetten van de transmissie en de ontwikkeling van de verschillende stadia, de interactie tussen parasiet en gastheer, de diagnose en behandeling, de geografische verspreiding of opties voor het beheer, maken wereldwijd nog steeds deel uit van lopend onderzoek.
Het is dan ook zeker niet onze intentie om hier een volledig overzicht van al deze literatuur of een huidige stand van zaken in het Echinococcus-onderzoek te schetsen. Hiervoor zijn recente specifieke reviews beter aangewezen (Deplazes et al. 2017; Oksanen et al. 2016). We brengen hier in grote lijnen enkel de informatie die rechtstreeks betrekking heeft op onze onderzoeksvragen en die helpt bij de interpretatie van onze resultaten.
2.1 Levenscyclus
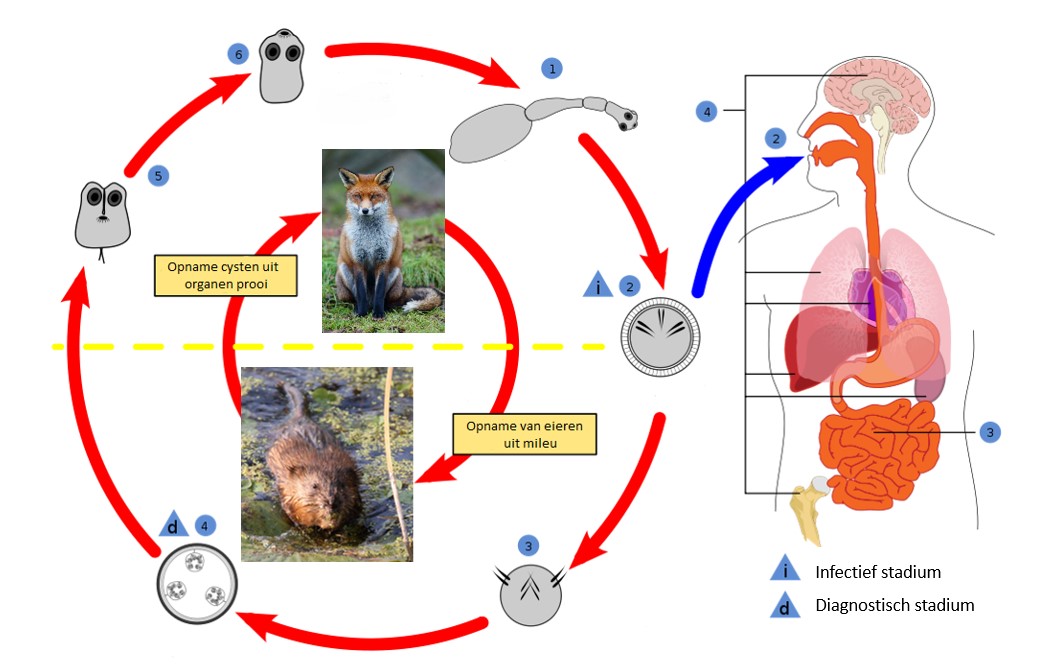
Figuur 2.1: Levenscyclus EM: Buitenste cirkel: 1. Volwassen lintworm in dunne darm 2. Eieren in uitwerpselen 3. Oncosfeer boort door de darmwand en komt in bloedbaan terecht 4. Metacestode in lever 5. Protoscoleces in darmstelsel eindgastheer 6. Vasthechting aan darmwand, Binnenste cirkel: gastheer waarin de respectievelijke EM stadia van de buitenste cirkel zich bevinden, de gele stippelijn duid de overgang tussen tussengastheer en eindgastheer aan (© D. Richfield 2014).
2.1.1 Vrijlevend ei-stadium
De rijpe EM eieren komen via de uitwerpselen van de eindgastheer in de buitenwereld. Ze hebben een diameter van 30 tot 40µm diameter en bevatten het eerste larve-stadium (de oncosfeer) van de lintworm. De oncosfeer wordt gekenmerkt door 6 bewegelijke haken en is omgeven door een eikapsel bestaande uit verschillende lagen. Eén van die lagen is de resistente, sterk gekeratiniseerde embryophore. De EM eieren zijn morfologisch niet te onderscheiden van die van lintwormen van het genus Taenia (Eckert et al. 2001). Eens ze de eindgastheer hebben verlaten zijn de eieren onderhevig aan verschillende omgevingsfactoren. EM eieren kunnen doorheen het jaar geruime tijd infectieus blijven (Veit et al. 1995). Uit laboratoriumtesten bleek bovendien dat de eieren 240 dagen temperaturen tot -18°C kunnen weerstaan maar binnen de twee dagen sterven bij -83°C. Ook bij te hoge temperaturen sterven de eieren snel af. Federer et al. (2015) tonen aan dat de eieren temperaturen tot 65°C kunnen overleven zolang de blootstelling beperkt is in tijd (niet meer dan 3 uur) en er voldoende luchtvochtigheid is. In een drogere omgeving blijkt de overleving (infectiviteit) van de eieren sterk af te nemen. Deze gevoeligheden worden ook teruggevonden op ruimtelijk grotere schaal. Staubach et al. (2001) vonden meer geïnfecteerde vossen in open landschappen met een vochtige bodem, en lagere percentages in droger bosgebied.
2.1.2 Ontwikkeling in de tussengastheer
Verschillende kleine zoogdieren kunnen als tussengastheer voor EM optreden, waaronder ook bevers (Castor fiber), hazen (Lepus europaeus) en beverratten (Myocastor coypus) (Romig et al. 2017). Het zijn echter de woelrat (Arvicola amphibius), de veldmuis (Microtus arvalis) en de muskusrat die als de belangrijkste tussengastheren in Europa worden beschouwd (Eckert et al. 2001). Ze behoren alle drie tot de onderfamilie van de woelmuizen of Arvicolinae. Recent onderzoek van Oksanen et al. (2016) geeft ons een indicatie van de prevalentie van EM in deze soorten in België en buurlanden (Tabel 2.1). De prevalentie van 16% in muskusratten in België is berekend op basis van twee studies uit Wallonië (Mathy et al. 2009; Hanosset et al. 2008). Belangrijk (ten opzichte van Vlaanderen) hierbij is dat de regio ten noorden van de Samber-Maas-lijn slechts een prevalentie van 2,02% (95 % CI: 1,08–3,43%) vertoont.
| België | Nederland | Duitsland | Luxemburg | Frankrijk | |
|---|---|---|---|---|---|
| Muskusrat | 16,0 (7,0 - 28,0) | 0,06* | 3,8 (2,8 - 4,9) | 1,8* | 1,1 (0,2 - 2,8) |
| Arvicolinae | 0,2 (0,0 - 0,6) | 0,6 (0,4 - 1,0) | 4,8 (1,6 - 9,7) |
De prevalentie die we zien bij de tussengastheer weerspiegelt deze van de eindgastheer. In geval van screening bij de tussengastheer dient dit wel grondiger te gebeuren aangezien de gemiddelde prevalentie van alle tussengastheren ongeveer één derde van de prevalentie bij de eindgastheer bedraagt (Oksanen et al. 2016).
Eenmaal een lintwormei opgenomen is door een tussengastheer, komt onder de opeenvolgende invloed van de enzymen in de maag en de darm de oncosfeer vrij uit het eikapsel. De oncosfeer bestaat slechts uit een beperkt aantal, sterk gespecialiseerde cellen en wordt het eerste larvestadium genoemd. Gal aanwezig in de dunne darm activeert de oncosfeer en door middel van de beweeglijke haken en bepaalde secreties dringt ze door de darmwand. Eens in de submucosa wordt de oncosfeer passief via de bloedsomloop getransporteerd naar de lever of meer uitzonderlijk naar longen, hersenen of andere organen (Eckert et al. 2001).
Hier begint de oncosfeer aan de metamorfose naar het tweede larvestadium, de metacestode. De oncosfeer bevat een klein aantal ongedifferentieerde stamcellen die aan de basis liggen van deze metamorfose, terwijl de meeste gedifferentieerde cellen verloren gaan tijdens de transitie. Op dit punt is de parasiet het meest gevoelig voor de immunologische respons van de tussengastheer. De metacestode bestaat uit een verzameling vesikels (cel-organellen). Deze vesikels vermeerderen zich en kunnen zich in het lichaam verspreiden en dwars door aangrenzend weefsel groeien en zodoende ernstige aandoeningen veroorzaken. Binnen deze vesikels ontstaan broedkapsels waarin de protoscoleces zich ontwikkelen. Grote hoeveelheden protoscoleces worden binnen de 40 tot 60 dagen na infectie al aangemaakt. Het zijn deze protoscoleces die zich in de eindgastheer elk tot een individuele lintworm zullen ontwikkelen. De sterke ontwikkeling van de metacestode kan ertoe leiden dat de tussengastheer minder mobiel wordt en dus een makkelijke prooi vormt voor een predator, een mogelijke eindgastheer (Eckert et al. 2001).
De eieren kunnen ook opgenomen worden door zoogdieren die losstaan van de levenscyclus. Men spreekt dan van een aberrante of toevallige gastheer. Dit kan onder meer het geval zijn bij de mens maar ook bij o.a. everzwijnen (Sus scrofa), honden (Canis lupus familiaris), hazen (Lepus europaeus) en varkens (Sus scrofa domesticus) (Oksanen et al. 2016; Chaignat et al. 2015; Romig et al. 2017).
2.1.3 Ontwikkeling in de eindgastheer
De vos (Vulpes vulpes) is de belangrijkste eindgastheer van Echinococcus multilocularis in Europa. In bepaalde streken kunnen andere carnivoren zoals de wasbeerhond (Nyctereutes procyonoides), de wilde kat (Felis silvestris) of de wolf (Canis lupus) als eindgastheer optreden. Ook huiskatten (Felis catus) of honden kunnen deze parasiet dragen. In België is hier nog geen onderzoek naar verricht, maar wel in Frankrijk, Luxemburg, Duitsland en Nederland. In Frankrijk werd een prevalentie van 1.5% bij huiskatten en 0.4% bij honden gevonden, in Duitsland was dit respectievelijk 0.6 en 0.3%, in Nederland 0.3% bij huiskatten en geen geïnfecteerde honden en in Luxemburg werden geen geïnfecteerde huiskatten of honden gevonden (Oksanen et al. 2016).
In onze buurlanden vinden we dus een erg lage prevalentie bij huiskatten en honden. Hegglin and Deplazes (2013) berekenden echter dat, zelfs bij een geringe prevalentie van 0.3 tot 0.4%, honden 10% kans hebben om ooit in hun leven geïnfecteerd te raken. Aangezien honden in veel hogere aantallen in urbane omgevingen voorkomen dan vossen kunnen zij substantieel bijdragen aan de hoeveelheid lintwormeieren in de directe nabijheid van mensen. Zo zouden 4-15% van de eieren in rurale en 7-19% van de eieren in urbane gebieden afkomstig zijn van honden. Geïnfecteerde katten daarentegen scheiden slechts kleine hoeveelheden eieren uit, Kapel et al. (2006) vonden bovendien dat deze niet infectieus zijn.
De eindgastheer raakt besmet met de parasiet door het eten van geïnfecteerde prooien. De protoscoleces afkomstig uit de organen van de tussengastheer ontwikkelen zich in de dunne darm tot (adulte) lintwormen en voeden zich met de darminhoud van de eindgastheer. De volwassen lintworm is slechts enkele millimeter groot en bestaat gemiddeld uit vijf proglotiden of segmenten (Eckert and Deplazes 2004). Na een prepatente periode van 26 tot 29 dagen worden tot 100.000 eieren per dag geproduceerd (Kapel et al. 2006). Deze excretie kan tot vier maanden duren (Eckert et al. 2001). Eens de eieren uitgescheiden zijn in het milieu kan de cyclus opnieuw van voor af aan beginnen.
2.2 Verspreiding
Zuid-Duitsland, Zwitserland, alpien Oostenrijk en bepaalde zones in Rusland (rond Moskou, Kazan en Tomsk) worden historisch als endemisch besmet gebied beschouwd (Eckert and Thompson 2017). De Europese besmette regio vertoont sinds de jaren 1970 een uitbreiding naar het noorden, westen en oosten. Zo observeerden Combes et al. (2012) een sterke westwaartse uitbreiding van de vossenlintworm in vossen in Frankrijk. In Nederlands Limburg werd dan weer een noordwaartse verspreiding gevonden en werd berekend dat deze verspreiding zich voordoet met een snelheid van 2,7 km per jaar (Takumi et al. 2008).
Vervaeke et al. (2006) zien ook een noordwestwaartse uitbreiding van de infectie in vossen in België, beginnende vanuit het zuidoosten van het land. Zij observeren echter ook dat in 2000-2002 de verspreiding ter hoogte van de gewestgrens lijkt te stabiliseren. Dit zien we ook terugkomen in de recent opgemaakte kaart van de verspreiding binnen Europa (Fig. 2.2), waar Wallonië een prevalentie kent tussen 5 en 25%, en de prevalentie in Vlaanderen tussen de 0 en 1% bedraagt (Eckert and Thompson 2017).
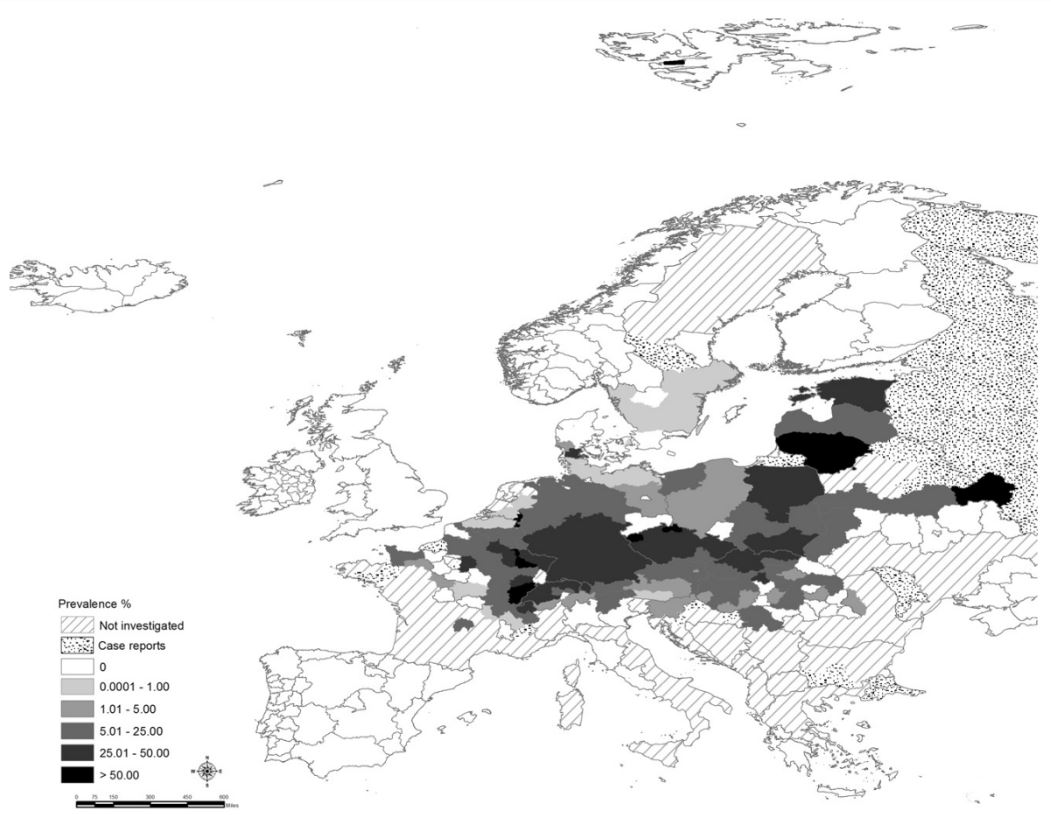
Figuur 2.2: Huidige prevalentie van EM in de eindgastheer in Europa. In de gestippelde gebieden is geen data over prevalentie in de eindgastheer beschikbaar maar er zijn wel gevallen bekend van EM infectie van tussengastheren of de mens (naar Deplazes et al. (2017)).
| Locatie | Jaar | Vossen | % besmet | Muskus- ratten |
% besmet | Bron |
|---|---|---|---|---|---|---|
Wallonië |
1991-1992 |
85 |
15 |
Brochier et al. (1992) |
||
Wallonië |
1998-2002 |
709 |
20.2 |
Losson et al. (2003) |
||
Wallonië |
2003-2004 |
178 |
41.6 |
Flament (2004) |
||
Wallonië |
2003-2004 |
993 |
24.4 |
1727 |
11.8 |
Hanosset et al. (2008) |
Wallonië (Ourthe vallei) |
2005-2006 |
657 |
22.1 |
Mathy et al. (2009) |
||
Brussel |
2001-2004 |
160 |
0 |
Brochier et al. (2007) |
||
Brussel |
2007-2008 |
56 |
0 |
Van Gucht et al. (2010) |
||
Vlaanderen |
1996-1999 |
237 |
1.69 |
Vervaeke et al. (2003) |
||
Vlaanderen |
2007-2008 |
136 |
0 |
Van Gucht et al. (2010) |
||
Vlaanderen |
10/2012-12/2012 |
306 |
1.96 |
Vervaeke and Claes (2012) |
||
Vlaanderen |
10/2013-01/2014 |
303 |
2.64 |
|||
Vlaanderen |
10/2014-12/2014 |
316 |
1.58 |
Uit tabel 2.2 blijkt duidelijk dat de prevalentie in Wallonië een stuk hoger is dan in Vlaanderen. Ook zien we dat de prevalentie in vossen in Vlaanderen vrij stabiel blijft. Wanneer we kijken naar de verspreiding (Fig. 2.3) zien we dat de meeste geïnfecteerde vossen in Vlaanderen dicht bij de gewestgrens gevonden worden.
Figuur 2.3: Verspreiding en infectiestatus van onderzochte vossen in België (Icon made by Freepik from www.flaticon.com.)
2.3 Risisco voor de mens: Alveolaire echinococcose (AE)
Echinococcose is een zoönose (een ziekte overgedragen van dieren op mensen) veroorzaakt door een besmetting met lintwormen van het genus Echinococcus. Echinococcose bestaat in vier vormen, elk veroorzaakt door een andere soort lintworm:
| Ziekte | Soort |
|---|---|
| Cystische echinococcose of hydatidose | Echinococcus granulosis |
| Aveolaire echinococcose | Echinococcus multilocularis |
| Polycystische echinococcose | Echinococcus vogeli |
| Unicystische echinococcose | Echinococcus oligarthrus |
De eerste twee vormen, cystische en alveolaire echinococcose, zijn belangrijk voor de wereldvolksgezondheid. De muskusrat speelt enkel een rol in de verspreiding van Echinococcus multilocularis en het risico op Alveolaire echinococcose (AE). Tussengastheren voor Echinococcus granulosis zijn hoefdieren, voornamelijk schapen en geiten, eindgastheren zijn voornamelijk honden maar wilde carnivoren kunnen deze rol ook opnemen.
2.3.1 Infectie, detectie en behandeling
De meeste gevallen van AE vinden we in Europa in de leeftijdsgroep tussen de 50 en 70 jaar, hoewel gevallen vanaf 10 en tot 89 jaar bekend zijn. De kans is even groot voor mannen als vrouwen om besmet te geraken. Mensen die actief zijn in de bosbouw, tuinbouw, landbouw, jagerij, of die een hond of kat (hoewel andere resultaten dit tegenspreken voor katten, zie hierboven) bezitten hebben een hogere kans op infectie (Eckert et al. 2001; Vuitton et al. 2015; Craig et al. 2017). Belangrijk om op te merken is dat zelfs in endemische gebieden de prevalentie zeer laag is bij mensen (11-40 gevallen per 100.000 inwoners). De meeste gevallen vinden we bij oudere of immunodeficiëntie mensen waardoor we kunnen besluiten dat de mens een sterke aangeboren resistentie tegen AE heeft (Eckert et al. 2001).
Nadat de eieren via het spijsverteringstelsel opgenomen zijn, ontwikkelt de oncosfeer zich in de lever tot metacestode op vergelijkbare manier als bij andere tussengastheren. Dit letsel in de lever is tussen een paar millimeter en 20 cm groot, soms met centrale necrose tot gevolg. Van hieruit kan de infectie zich via het lymfe- of bloedvatensysteem verspreiden naar andere organen. Tussen infectie en het optreden van symptomen zit bij mensen een incubatietijd van vijf tot vijftien jaar. De eerste symptomen zijn geelzucht (1/3 van de gevallen) en buikpijn (1/3 van de gevallen). De overige gevallen worden ontdekt bij onderzoek naar aanleiding van vermoeidheid, gewichtsverlies, hepatomegalie (een vergrote lever) of abnormale resultaten van specifieke laboratorium- of echografie-testen (Eckert et al. 2001).
Bij een vermoeden van AE op basis van voornoemde symptomen wordt een echografie of CT-scan uitgevoerd waarbij wordt nagegaan of de lever vergroot is en de kenmerkende laesies vertoont. Ook biochemisch kan de parasiet aangetoond worden: bepaalde testen kunnen antilichamen tegen EM vinden (1/2 van de patiënten vertoont deze), na biopsie van de lever kan histologisch onderzoek of PCR-analyse uitsluitsel geven (Eckert et al. 2001).
De behandeling van AE bestaat uit het chirurgisch verwijderen van de aangetaste delen van de lever en andere organen. Dit wordt dan gevolgd door minstens twee jaar chemotherapie. Indien de infectie te wijdverbreid is en er niet meer geopereerd kan worden, dient levenslang chemotherapie gevolgd te worden (Eckert et al. 2001). Wanneer men tijdig kan ingrijpen, is aangetoond dat Europese patiënten een vergelijkbare levensverwachting hebben als de rest van de bevolking (Torgerson et al. 2008; Piarroux et al. 2011).
2.3.2 Prevalentie
Wereldwijd komen naar schatting een 18.000 gevallen van AE per jaar voor. Van deze gevallen komt er 91% voor in China en slechts 8.8% in Europa, Rusland en Centraal-Azië. In Noord-Amerika komen dus zeer weinig gevallen van AE voor. Voor zover gekend beperkt de verspreiding zich tot het noordelijke halfrond (Torgerson et al. 2010).
De meeste klinische patiënten in Europa worden geregistreerd in het endemisch gebied gelegen in Zwitserland, Zuid-Duitsland en delen van Oostenrijk en Frankrijk. In deze gebieden neemt het aantal gevallen van AE toe en bovendien komen er ook steeds meer gevallen voor waar er historisch geen voorkwamen, vooral in centraal-oost Europa en de Baltische landen. Deze toename kan mogelijk verklaard worden door een toegenomen aandacht voor de ziekte en een betere screening. Maar ook na het algemeen beschikbaar worden van echografie in de jaren 1970 zet deze stijgende trend zich verder. Verklaringen voor deze verdere toename dienen dus eerder gezocht te worden in de toename van het aantal tussengastheren, en/of de toegenomen vossenpopulatie en hun urbanisatie (Vuitton et al. 2015). Mogelijke andere verklaringen zijn de toegenomen populariteit van outdoor-activiteiten waardoor mensen meer en meer het leefgebied van mogelijk besmette dieren betreden. Verder zal de bevolkingsgroei ook leiden tot hogere absolute aantallen besmette mensen.
Hoewel België geen historisch endemisch gebied is, zijn ook hier gevallen van AE bekend. Tussen 1996 en 2000 werden in kader van het EurEchinoReg project drie gevallen van AE in België gevonden (Kern et al. 2003). De meest recente gegevens (Fig. 2.4) zijn afkomstig van Sciensano, dat samengesteld is uit het voormalige Centrum voor Onderzoek in Diergeneeskunde en Agrochemie (CODA) en het vroegere Wetenschappelijk Instituut Volksgezondheid (WIV). Zij rapporteren de resultaten van het referentielaboratorium aan de ULB, waar jaarlijks ongeveer 250 tot 300 serologische testen uitgevoerd worden om antilichaampjes tegen EM te detecteren (Rebolledo et al. 2017). Bovendien is dit laboratorium het verzamelpunt waar AE gevallen uit België gemeld kunnen worden, hoewel dit geen verplichting is in België (Carlier Y., persoonlijke mededeling).
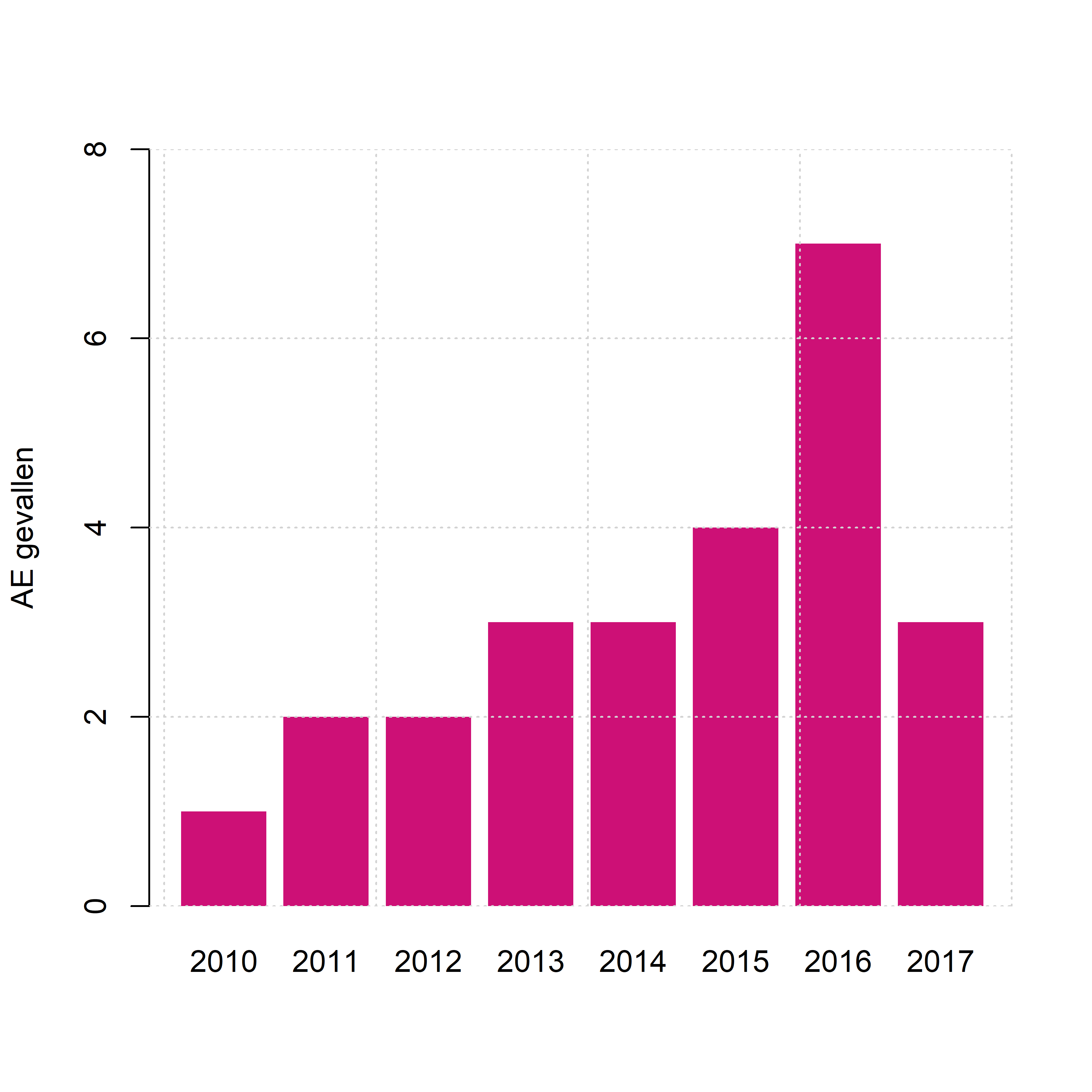
Figuur 2.4: Aantal gerapporteerde gevallen van alveolaire echinococcose per jaar in België in de periode 2010-2017 (Litzroth and Truyens 2017).
Referenties
Brochier, B, P Coppens, Bertrand Losson, Bernard Mignon, MFA Aubert, B Bauduin, MJ Barrat, et al. 1992. “Enquête Sur L’infestation Du Renard Roux (Vulpes Vulpes) Par Echinococcus Multilocularis En Province de Luxembourg (Belgique).” In Annales de Médecine Vétérinaire, 136:497–504. Université de Liège.
Brochier, B, H De Blander, R Hanosset, D Berkvens, Bertrand Losson, and Claude Saegerman. 2007. “Echinococcus Multilocularis and Toxocara Canis in Urban Red Foxes (Vulpes Vulpes) in Brussels, Belgium.” Preventive Veterinary Medicine 80 (1). Elsevier: 65–73.
Chaignat, Valérie, Patrick Boujon, Caroline F Frey, Brigitte Hentrich, Norbert Müller, and Bruno Gottstein. 2015. “The Brown Hare (Lepus Europaeus) as a Novel Intermediate Host for Echinococcus Multilocularis in Europe.” Parasitology Research 114 (8). Springer: 3167–9.
Combes, Benoît, Sébastien Comte, Vincent Raton, Francis Raoul, Franck Boué, Gérald Umhang, Stéphanie Favier, Charlotte Dunoyer, Natacha Woronoff, and Patrick Giraudoux. 2012. “Westward Spread of Echinococcus Multilocularis in Foxes, France, 2005–2010.” Emerging Infectious Diseases 18 (12). Centers for Disease Control; Prevention: 2059.
Craig, P S, Daniel Hegglin, M W Lightowlers, Paul R Torgerson, and Q Wang. 2017. “Echinococcosis: Control and Prevention.” In Advances in Parasitology, 96:55–158. Elsevier.
Deplazes, P, L Rinaldi, CA Alvarez Rojas, PR Torgerson, MF Harandi, T Romig, D Antolova, et al. 2017. “Global Distribution of Alveolar and Cystic Echinococcosis.” In Advances in Parasitology, 95:315–493. Elsevier.
Eckert, J, and RCA Thompson. 2017. “Historical Aspects of Echinococcosis.” In Advances in Parasitology, 95:1–64. Elsevier.
Eckert, Johannes, and Peter Deplazes. 2004. “Biological, Epidemiological, and Clinical Aspects of Echinococcosis, a Zoonosis of Increasing Concern.” Clinical Microbiology Reviews 17 (1). Am Soc Microbiol: 107–35.
Eckert, Johannes, MA Gemmell, François-Xavier Meslin, ZS Pawlowski, World Health Organization, and others. 2001. “WHO/Oie Manual on Echinococcosis in Humans and Animals: A Public Health Problem of Global Concern.” Paris, France: World Organisation for Animal Health.
Federer, Karin, Maria Teresa Armua-Fernandez, Stefan Hoby, Christian Wenker, and Peter Deplazes. 2015. “In Vivo Viability of Echinococcus Multilocularis Eggs in a Rodent Model After Different Thermo-Treatments.” Experimental Parasitology 154. Elsevier: 14–19.
Flament, I. 2004. “L’échinococcose Alvéolaire Chez Le Renard Roux Vulpes Vulpes En Région Wallonne, et Approche Non Exhaustive Des Helminthes Des Carnivores.” Haute école Provincial de Hainaut Occidental.
Hanosset, R, Claude Saegerman, S Adant, L Massart, and Bertrand Losson. 2008. “Echinococcus Multilocularis in Belgium: Prevalence in Red Foxes (Vulpes Vulpes) and in Different Species of Potential Intermediate Hosts.” Veterinary Parasitology 151 (2-4). Elsevier: 212–17.
Hegglin, Daniel, and Peter Deplazes. 2013. “Control of Echinococcus Multilocularis: Strategies, Feasibility and Cost–benefit Analyses.” International Journal for Parasitology 43 (5). Elsevier: 327–37.
Kapel, Christian MO, PR Torgerson, RCA Thompson, and P Deplazes. 2006. “Reproductive Potential of Echinococcus Multilocularis in Experimentally Infected Foxes, Dogs, Raccoon Dogs and Cats.” International Journal for Parasitology 36 (1). Elsevier: 79–86.
Kern, Petra, Karine Bardonnet, Elisabeth Renner, Herbert Auer, Zbigniew Pawlowski, Rudolf W Ammann, Dominique A Vuitton, Peter Kern, and others. 2003. “European Echinococcosis Registry: Human Alveolar Echinococcosis, Europe, 1982–2000.” Emerging Infectious Diseases 9 (3). Centers for Disease Control; Prevention: 343.
Litzroth, A, and C Truyens. 2017. “Epidemiologische Surveillance van Echinococcose.” Brussel, België: Wetenschappelijk Instituut Volksgezondheid.
Losson, Bertrand, Thierry Kervyn, Jacques Detry, P-P Pastoret, Bernard Mignon, and Bernard Brochier. 2003. “Prevalence of Echinococcus Multilocularis in the Red Fox (Vulpes Vulpes) in Southern Belgium.” Veterinary Parasitology 117 (1-2). Elsevier: 23–28.
Mathy, Anne, Régis Hanosset, S Adant, and Bertrand Losson. 2009. “The Carriage of Larval Echinococcus Multilocularis and Other Cestodes by the Musk Rat (Ondatra Zibethicus) Along the Ourthe River and Its Tributaries (Belgium).” Journal of Wildlife Diseases 45 (2). Wildlife Dis Assoc: 279–87.
Oksanen, Antti, Mar Siles-Lucas, Jacek Karamon, Alessia Possenti, Franz J Conraths, Thomas Romig, Patrick Wysocki, et al. 2016. “The Geographical Distribution and Prevalence of Echinococcus Multilocularis in Animals in the European Union and Adjacent Countries: A Systematic Review and Meta-Analysis.” Parasites & Vectors 9 (1). BioMed Central: 519.
Piarroux, Martine, Renaud Piarroux, Roch Giorgi, Jenny Knapp, Karine Bardonnet, Bertrand Sudre, Jérôme Watelet, et al. 2011. “Clinical Features and Evolution of Alveolar Echinococcosis in France from 1982 to 2007: Results of a Survey in 387 Patients.” Journal of Hepatology 55 (5). Elsevier: 1025–33.
Rebolledo, Javiera, Amber Litzroth, Katrien Tersago, Dominique Van Beckhoven, and Tinne Lernout. 2017. “Zoönosen En Vectoroverdraagbare Ziekten.” Brussel, België: Wetenschappelijk Instituut Volksgezondheid.
Romig, T, P Deplazes, D Jenkins, Patrick Giraudoux, Alessandro Massolo, Philip S Craig, M Wassermann, K Takahashi, and M De La Rue. 2017. “Ecology and Life Cycle Patterns of Echinococcus Species.” In Advances in Parasitology, 95:213–314. Elsevier.
Staubach, CHRISTOPH, Hans-hermann Thulke, Kirsten Tackmann, MARTIN Hugh-Jones, and FRANZ J Conraths. 2001. “Geographic Information System-Aided Analysis of Factors Associated with the Spatial Distribution of Echinococcus Multilocularis Infections of Foxes.” The American Journal of Tropical Medicine and Hygiene 65 (6). ASTMH: 943–48.
Takumi, Katsuhisa, Ankje de Vries, Mei Ling Chu, Jaap Mulder, Peter Teunis, and Joke van der Giessen. 2008. “Evidence for an Increasing Presence of Echinococcus Multilocularis in Foxes in the Netherlands.” International Journal for Parasitology 38 (5). Elsevier: 571–78.
Torgerson, Paul R, Krista Keller, Mellissa Magnotta, and Natalie Ragland. 2010. “The Global Burden of Alveolar Echinococcosis.” PLoS Neglected Tropical Diseases 4 (6). Public Library of Science: e722.
Torgerson, Paul R, Alexander Schweiger, Peter Deplazes, Maja Pohar, Jürg Reichen, Rudolf W Ammann, Philip E Tarr, Nerman Halkik, and Beat Müllhaupt. 2008. “Alveolar Echinococcosis: From a Deadly Disease to a Well-Controlled Infection. Relative Survival and Economic Analysis in Switzerland over the Last 35 Years.” Journal of Hepatology 49 (1). Elsevier: 72–77.
Van Gucht, S, K Van Den Berge, P Quataert, P Verschelde, and I Le Roux. 2010. “No Emergence of Echinococcus Multilocularis in Foxes in Flanders and Brussels Anno 2007–2008.” Zoonoses and Public Health 57 (7-8). Wiley Online Library: e65–e70.
Veit, P, B Bilger, V Schad, J Schäfer, W Frank, and R Lucius. 1995. “Influence of Environmental Factors on the Infectivity of Echinococcus Multilocularis Eggs.” Parasitology 110 (1). Cambridge University Press: 79–86.
Vervaeke, M, Pierre Dorny, F Vercammen, S Geerts, J Brandt, K Van Den Berge, and R Verhagen. 2003. “Echinococcus Multilocularis (Cestoda, Taeniidae) in Red Foxes (Vulpes Vulpes) in Northern Belgium.” Veterinary Parasitology 115 (3). Elsevier: 257–63.
Vervaeke, Muriel, and Leen Claes. 2012. “Vossenlintworm Komt Slechts Zeer Beperkt Voor in Vlaanderen: Overzicht van de Surveillance van Echinococcus Multilocularis Bij de Vossenpopulatie in Het Vlaamse Gewest in de Periode Oktober-December.”
Vervaeke, Muriel, and Leen Claes. 2014a. “Geen Toename van de Vossenlintworm in Vlaanderen: Overzicht van de Surveillance van Echinococcus Multilocularis Bij de Vossenpopulatie in Het Vlaamse Gewest in de Periode Oktober 2013-Januari 2014.”
Vervaeke, Muriel, and Leen Claes. 2014b. “Geen Toename van de Vossenlintworm in Vlaanderen: Overzicht van de Surveillance van Echinococcus Multilocularis Bij de Vossenpopulatie in Het Vlaamse Gewest in de Periode Oktober 2014-December 2014.”
Vervaeke, Muriel, Joke van der Giessen, Bernard Brochier, Bernard Losson, Kurt Jordaens, Ron Verhagen, Cor de Lezenne Coulander, and Peter Teunis. 2006. “Spatial Spreading of Echinococcus Multilocularis in Red Foxes (Vulpes Vulpes) Across Nation Borders in Western Europe.” Preventive Veterinary Medicine 76 (3-4). Elsevier: 137–50.
Vuitton, DA, F Demonmerot, J Knapp, C Richou, F Grenouillet, A Chauchet, L Vuitton, S Bresson-Hadni, and L Millon. 2015. “Clinical Epidemiology of Human Ae in Europe.” Veterinary Parasitology 213 (3-4). Elsevier: 110–20.